Az éghető gőzökről gázokról, az éghetőségről, az inertizálásról
(Szerző: Bónusz János)
A korábbi értelmezés szerint az égés oxigénfelvétel. Ma ennél kiterjedtebb az oxidáció fogalma, minden olyan folyamatot, amelyben az atomok, a molekulák vagy az ionok elektront adnak le, oxidációnak nevezzük, a redukció pedig elektronfelvételt jelent. Oxidáció csak akkor mehet végbe ha egy másik anyag atomja, molekulája, vagy ionja az elektront felveszi, vagyis redukálódik.
Ez a folyamat csak meghatározott feltételek mellett játszódik le.
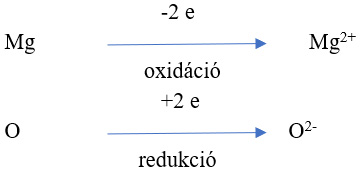
Az összetartozó oxidálódó és redukálódó anyag együttesen alkotja az ún. redox rendszert.
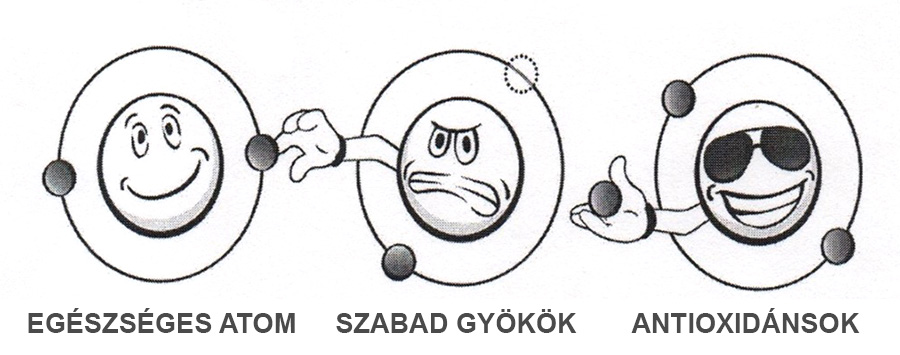
A vegyi folyamatokban gyakran vesznek rész olyan atomok vagy molekula részletek, amelyek párosítatlan elektronnal rendelkeznek, ezért nagyon gyorsan kémiai reakcióba lépnek más vegyületekkel elektronszerzés céljából. Az emberi szervezetre károsító hatásukat azzal fejtik ki, hogy testünk ép sejtjeiből igyekeznek elvenni a keresett elektront, ezzel rongálják a szervezet ép sejtjeit. A szabad gyökök nagy részét a szervezet antioxidánsokkal képes hatástalanítani.
Az égés összegezve:
- hőfejlődéssel járó kémiai folyamat
- nem mindig kell hozzá a levegő oxigénje (a klórban a hidrogén ég)
- öngyorsulásának feltételeit maga teremti meg
- kezdeti és végállapot közötti energia különbsége a környezetnek adódik át
- éghetőségi határ az alsó határértéket tiszta oxigénnel, a felső határértéket levegővel való méréssel állapítják meg
Az anyagok viselkedése hő hatására
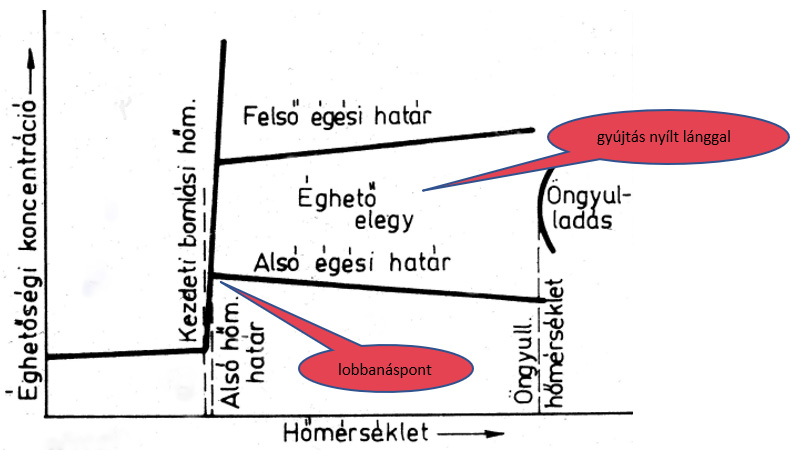
- gyulladási hőmérséklet: az anyag nyílt láng hatására meggyullad és ég
- öngyulladás: az a legkisebb szobahőmérséklet körüli hőmérséklet, ahol az anyag külső gyújtóforrás nélkül meggyullad
- elegyek vagy keverékek esetében csak egyedi méréssel lehet megállapítani a gyulladási hőmérsékletet
Az égés oxigén utánpótlás szerint
- kinetikai (kevert): éghető anyag + levegő keveréke, gyors láncreakció, ami robbanáshoz vezet
- diffúziós: oxigén utánpótlás, és az égéstermék távozása diffúzióval
- nem vezet robbanáshoz
A szilárd anyag égése
- a szilárd anyag nem ég, csak ha a hőmérséklet emelkedése következtében bekövetkezik annak bomlása, amit felületi reakció, pirolízis előz meg
- az égést az éghető gázok tartják fent
- döntően diffúziós formában ég
- a szilárd anyag folyadék módjára ég
- de a paraffin megolvad
- a naftalin és a kén szublimál
A folyadék égése
- az éghető folyadék nem ég, csak a gázfázisú állapotban a felületéről távozó gőz, a lobbanáspont feletti hőmérsékleten
- égés csak meghatározott koncentráció tartományban lehetséges
- az égési határ alatt nem ég, az égési határ felett sem ég csak ha hígulni tud
- lobbanáspont az égés alsó határa ez alatt nincs égés
- az égéshez kell a kellő ideig tartó gyújtási energia
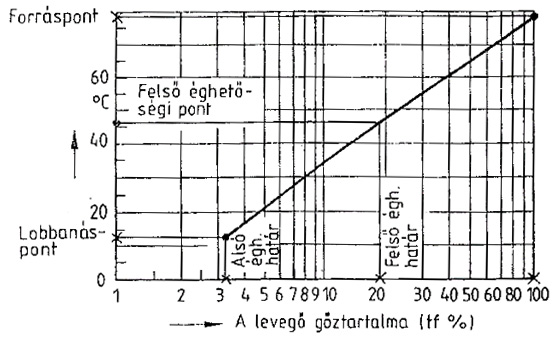
A hőmérséklet hatása az éghetőségre
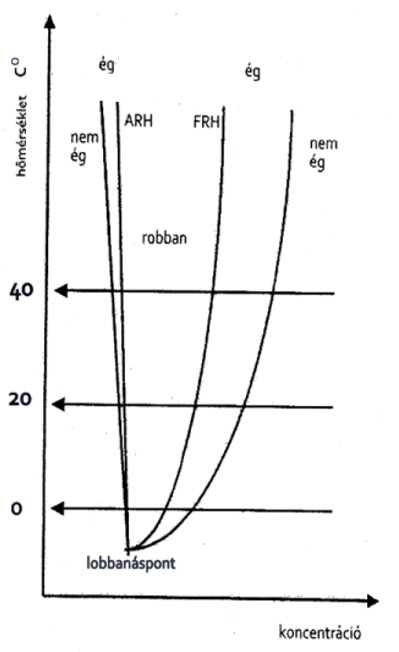
megjegyzés:
az irodalomban legtöbbször a 20 celsius fokhoz tartozó adatok találhatók
a lobbanáspont lehet zárttéri (ez csak elméletileg fontos)
nyílttéri, a legtöbb szakirodalom csak ezt tünteti fel.
A gázok, gőzök égése
- lehet kinetikai vagy kevert
- égés csak meghatározott koncentráció tartományban lehetséges
- az égési koncentráció alatt nem ég, az égési koncentráció felett sem ég csak ha hígulni tud
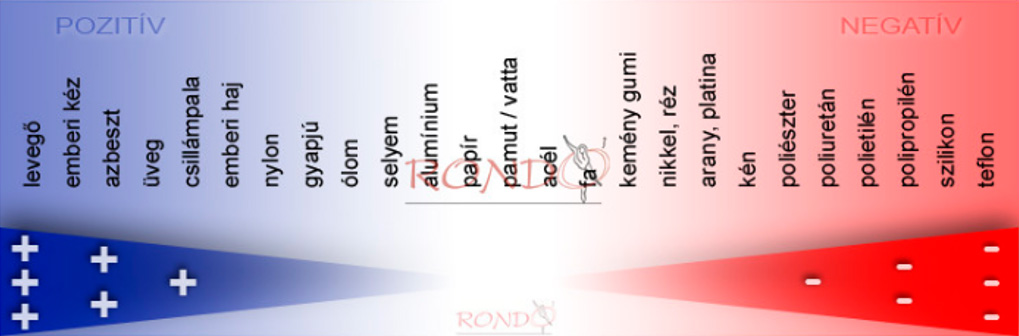
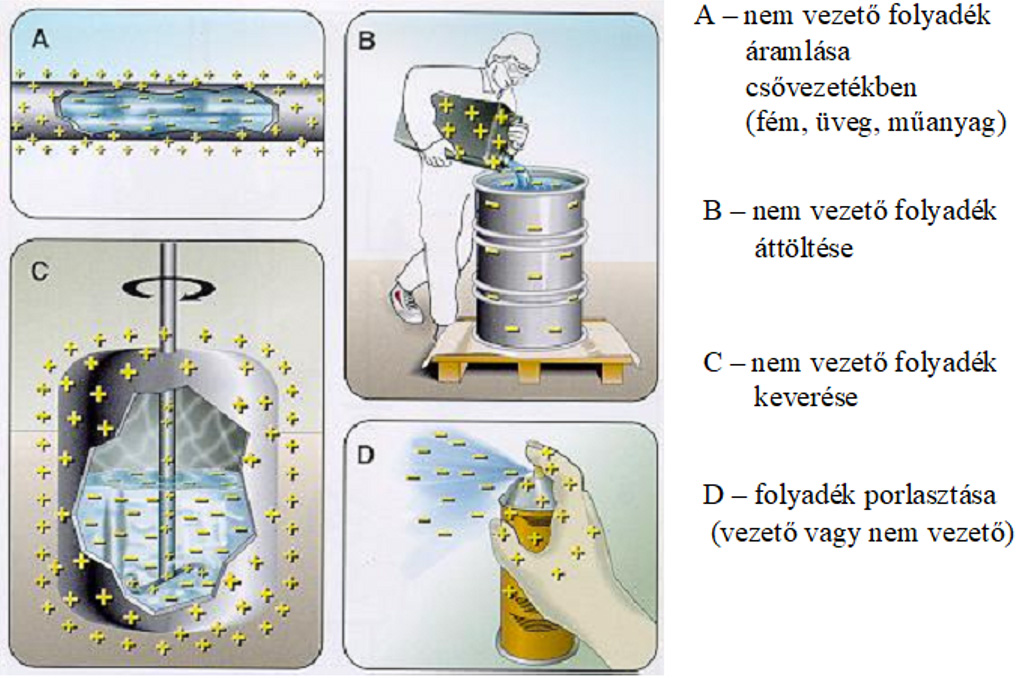
A gázok, gőzök sztatikus feltöltődése
A gázok gőzök porok áramlása során elektrosztatikus feltöltődések keletkeznek. A sztatikus feltöltődés akkor keletkezik, amikor egy külső erő hatására elektronok szakadnak ki az atomból és így az atom proton többlettel rendelkezik, pozitív töltéssel. Az elektronok „hozzátapadnak” egy fogadó atomhoz, amely ebből adódóan elektron többlettel bír és negatív töltésű lesz.
Your Content Goes Here
Néhány anyag gyulladási hőmérséklete
- gáz –gőz levegő elegy:
- benzin 200-300 °C
- szénmonoxid 605 °C
- dimetil-éter 160 °C
- por – levegő elegy:
- kén 236 °C
- polietilén 410 °C
Az anyagok öngyulladási hőmérséklete nem egy állandó érték
| anyag | a lombik mérete (ml-ben) |
öngyulladási hőmérséklet C0 |
| aceton | 8 | 676 |
| 200 | 519 | |
| 1000 | 491 | |
| 12000 | 467 | |
| etilalkohol | 8 | 495 |
| 200 | 402 | |
| 1000 | 391 | |
| 12000 | 363 | |
| toluol | 8 | 649 |
| 200 | 536 | |
| 1000 | 519 | |
| 12000 | 489 |
Alkalmazási csoport és gyújtási energia
| reprezentáns gáz-gőz csoport | alkalmazási csoport | minimális gyújtási energia (MIE) |
| metán | I illetve II A | 280 mJ |
| propán | II A | |
| hexán | II A | |
| szénmonoxid | II A | |
| etilacetát | II A | 180 mJ |
| etilén | II B | |
| etiléter | II B | |
| etilénoxid | II B | 60 mJ |
| acetilén | II C | |
| hidrogén | II C | |
| széndiszulfid | II C | 20 µJ |
I a bányák föld alatti része metán- szénpor
II a föld feletti gázok-gőzök csoport
II A etán csoport
II C hidrogén csoport
A levegővel érintkezve lángra lobban
- a sárga foszfor, víz alatt kell tárolni,
- vörösfoszfor a sárga foszfor nyomoktól öngyulladó
- fémporok
- Fe: fimon öngyulladó, durva (égő cigaretta is meggyújtja)
- Ti: megmunkálás vízhűtéssel, szállítás víz alatt
- Al, Zn por: inert nitrogén atmoszférában kezelik
- sók (karbonát, oxalát)
- Al, Zn alkil és fenil vegyülete fényre levegőn meggyullad
- szulfitok FeS + 2O2 Þ FeSO4
- a barna szén öngyulladását ez okozza
A víz hatására lángra lobbanó anyagok
- alkáli fémek, hidridek
- fém karbidok (CaC2, Cu2C2, Na2C2, Hg2C2)
- CaC2 csekély nedvességre is meggyullad
- Mg2Si nedvességre Mg(OH)2 + szilán (utóbbi levegőn gyullad)
- hidridek, foszfidek
Az oxidálószerek és szerves anyag redukciója
-
- salétromsav és fa szalma reakciója tüzet okoz
- olajos rongy (oxigéndús atmoszférában) öngyulladást okoz
- halogén elemek és H2, CH4, C2H2 reakciója szobahőmérsékleten meggyullad már fény hatására is bekövetkezhet a reakció
- KMnO4 a glicerint és a glikolt meggyújtja
- peroxidok bomlása hő hatására
- perecetsav szilárd állapotban mechanikai érzékenysége jelentősen megnő
- peroxi-trifluoroecetsav
- peroxi-benzoesav
- monoperoxi-ftálsav
A gázok gőzök sűrűségéről
Az MSZ 379-1982 Tűz- és robbanásveszélyes vegyi anyagok jellemzői (visszavonták:1995-ben) a szabvány szerint 478 éghető gőz és gáz van. A visszavonás nem érinti a kémiai fizikai tulajdonságokat. Ebben a szabványban 4 gáz a levegőnél könnyebb, ezek: H2, CO,CH4, C2H2 a levegővel közel azonos sűrűségű 111, a többi 463 nehezebb a levegőnél.
megjegyzés: az égési és robbanási határokat a szabvány összevonta
Az égési sebesség időtartam és a nyomás változása
| lobbanás | tartós égés | robbanás | detonáció | |
| lángterjedési sebesség | egy másodpercig | 0,5 m/s -tól néhány m/s ig | 100 m/s ig | 1500 ~ 2000 m/sig |
| nyomás | csekély | <0,01 bar | 0,01-10 bar | 20-100 bar |
megjegyzés: az égés gyorsabb tiszta oxigénben
A gyulladási hőmérséklet változása a nyomás függvényében
| anyag | 1 bar | 5 bar | 10 bar | 15 bar | 20 bar | 25 bar |
| benzin | 480 | 350 | 310 | 290 | 280 | 250 |
| benzol | 680 | 620 | 590 | 520 | 500 | 490 |
| petróleum | 460 | 330 | 250 | 220 | 210 | 200 |
A nyomás és hőmérséklet hatása az éghetőségre
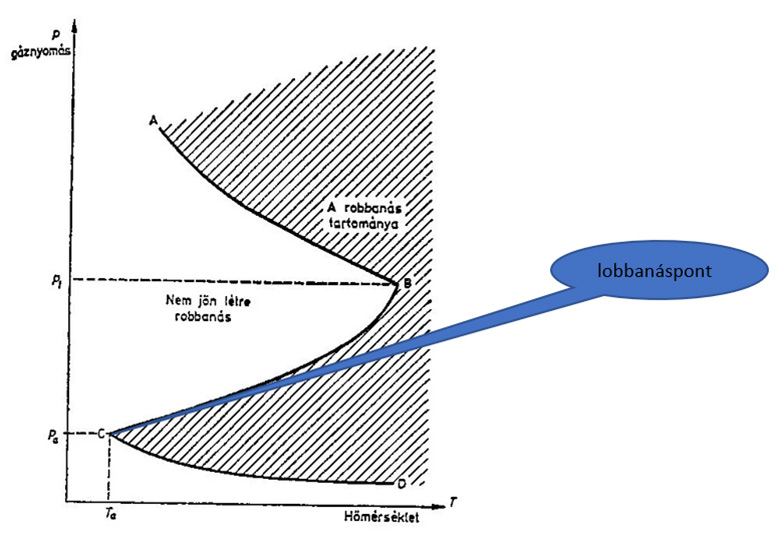
A lobbanáspont az a hőmérséklet, ahol először jelenik meg égni képes gőz-levegő elegy, ami nyílt lánggal meggyújtható.
A lobbanáspont alapján történő veszélyhelyzet megítélése
Minél nagyobb egy adott hőmérsékleten az anyag gőznyomása, annál több gőz keletkezik belőle.
1 liter folyadék butadiénből 265 liter butadién gőz lesz és kb. 25000 liter robbanásveszélyes keverék keletkezik.
1 liter folyadék benzinből 100 liter benzin gőz lesz, és kb. 9500 liter robbanásveszélyes keverék keletkezik.
Egy kanál benzin a 200 literes hordóban robbanásveszélyt okoz.

Az aceton lobbanáspontja – 19 C0 gőznyomása ezen a hőmérsékleten 160 mbar
gőznyomása 20 C0 hőmérsékleten 247 mbar
alsó robbanási határértéke 2,5 %
alsó robbanási határértéke 60 g/m3
gyulladási hőmérséklete 676 C0
az etilalkohol lobbanáspontja 12 C0 gőznyomása ezen a hőmérsékleten 30 mbar
gőznyomása 20 C0 hőmérsékleten 59 mbar
alsó robbanási határértéke 3,5 %
alsó robbanási határértéke 67 g/m3
gyulladási hőmérséklete 495 C0
megjegyzés: -adott hőmérsékleten annak a gőznek van nagyobb térfogata amelynek
alacsonyabb a lobbanáspontja (ez az aceton)
-az ATEX előírások szerint az Ex védettséget az alacsonyabb gyulladási
hőmérséklet alapján kell megállapítani (ez az etilalkohol)
– a robbanásveszély szempontjából a két gőz együttes jelenléte esetén az
etilalkohol védettsége szerint kell az Ex biztonságot kialakítani mind az
elektromos, mind a nem elektromos alkatrészek tekintetében
-a szellőztetést természetesen az aceton gőzőre kell méretezni
Ha az oldószer pg gőznyomása adott hőmérsékleten és pl légköri nyomáson ismert, akkor a munkatérbe került G óránkénti mennyisége az alábbi összefüggés szerint számítható
![]()
M = az oldószer (g) molekula tömege aceton M 58,08
V = a munkatér térfogata 100 m3
Pl : 1013 mbar
Pg : aceton 20 C0 hőmérsékleten 247 mbar
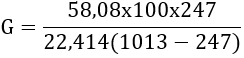
G= 83,57 g/h
Tehát az aceton gőzei egy szellőztetés nélküli 100 m3-es térben robbanásveszélyes töménységben van jelen. Megjegyzendő, hogy robbanásveszélyes térben túlnyomásos szellőzést nem szabad alkalmazni csak elszívás engedhető meg. Hatékony elszívás esetén nincs robbanásveszély.
M= az oldószer (g) molekula tömege etilalkohol M 46,07
Pl : 1013 mbar
Pg : etilalkohol 20 C0 hőmérsékleten 59 mbar
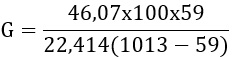
G= 12,71g/h
Tehát az etilalkohol gőzei egy szellőztetés nélküli 100 m3-es terében nem robbanásveszélyes töménységben van jelen, nincs robbanásveszély.
A szellőzés hatása a robbanásveszélyre
Előnyös, illetve az oldószergőz robbanásveszélyes koncentrációját csökkenti
– a légáramlás sebessége az ajtók, ablakok kinyitása
– a csökkenő hőmérséklet
– a légköri nyomás növekedése
– az oldószerek kisebb gőznyomása, ill. minél nagyobb forráspontja, párolgási száma
– minél nagyobb a munkahely térfogata
Hátrányos, illetve az oldószergőz töménységét és a robbanásveszélyt is növeli
– a hőmérséklet emelkedése
– csökkenő légköri nyomás
– az oldószerek gőznyomása, a kisebb forráspontja és párolgási száma
– az oldószerek levegőre vonatkoztatott nagyobb gőzsűrűsége
– az oldószergőzök levegővel való elegyedési hajlama
– a munkatér kis térfogata, ajtók, ablakok bezárása
– a párolgási felület, illetve fajlagos felület nagysága
A gáz–gőz–köd-por levegő elegy által okozott robbanási hatás az alábbiaktól függ
– az éghető gáz – gőz –köd tulajdonságai, tisztasága
– az éghető anyag koncentrációja, mennyisége
– az éghető keverék homogenitása és turbulenciája
– a gyújtóforrás típusa, energiája, elhelyezkedése
– az éghető keverék hőmérséklete, nyomása, nedvesség tartalma
– az éghető (és nem éghető) por szemcsemérete
A zónákról

megjegyzés: ahol nincs robbanásveszélyes töménységű gőz-gáz levegő elegy ott nincs zóna
A zóna kibocsátó forrástól bármilyen irányban mért távolsága addig a pontig tart, amelynél a gáz/levegő keveréke levegővel az alsó robbanási határ alatti értékre hígul fel.
| a kibocsátás fokozata |
szellőzés | ||||||
| fokozata | |||||||
| erős | közepes | gyenge | |||||
| üzembiztonság | |||||||
| jó | megfelelő | gyenge | jó | megfelelő | gyenge | jó, megfelelő gyenge |
|
| folyamatos | 0-ás zóna EH nem robbanás veszélyes 1) |
0-ás zóna EH 1-es zóna 1) |
0-s zóna EH 1-es zóna 1) |
0-s zóna | 0-s zóna + 1-es zóna |
0-s zóna + 1-es zóna |
0-s zóna |
| elsőrendű | 1-es zóna EH nem robbanásveszélyes 1) |
1-es zóna EH 2-es zóna 1) |
1-es zóna EH 2-es zóna 1) |
1-es zóna | 1-es zóna + 2-es zóna |
1-es zóna + 2-es zóna |
1-es zóna vagy 0-s zóna 3) |
| másodrendű | 2-es zóna EH nem robbanás veszélyes 1) |
2-es zóna EH nem robbanásveszélyes 1) |
2-es zóna | 2-es zóna | 2-es zóna | 2-es zóna | 1-es zóna és 0-s zóna 3) |
| 1) A 0-s EH 1-es és a 2-es EH egy elméleti zónát jelent, amelynek normál üzemi feltételek között elhanyagolható a kiterjedése 0-s zóna lesz, ha a szellőzés gyenge és a kibocsátás olyan, hogy a robbanóképes gázközeg gyakorlatilag folyamatosanfennáll azaz megközelíti a szellőzés nélküli esetet. |
|||||||
| Megjegyzés: A + jel után az adott zóna körül lévő zóna van feltüntetve ha van. | |||||||
Néhány éghető folyadék adatai 20 C0-on
| megnevezés | lobbanás pont C0 | alsó robbanási határ térf.% | felső robbanási határ térf.% | gőzsűrűség a levegőhöz képest | egészségre még nem ártalmas koncentráció mg/m3 | molekula tömeg |
| Aceton | -19,0 | 2,5 | 13,0 | 2,00 | 200,0 | 58,08 |
| Benzol | -11,0 | 1,2 | 8,0 | 2,70 | 5,0 | 78,11 |
| Butilacetát | 22,0 | 1,2 | 7,0 | 4,00 | 200,0 | 116,16 |
| Butilalkohol | 29,0 | 1,7 | 11,3 | 2,55 | 100,0 | 74,12 |
| Etilalkohol | 12,0 | 3,5 | 15,0 | 1,59 | 1000,0 | 46,07 |
| Etilacetát | -4,0 | 2,1 | 11,5 | 3,04 | 200,0 | 88,11 |
| Foltbenzin | -24,0 | 1,1 | 8,0 | 2,80 – 4,00 | 300,0 | » 100,00 |
| Lakkbenzin | 21,0 | 0,8 | 8,6 | 2,80 – 5,00 | 300,0 | » 150,00 |
| Toluol | -7,0 | 1,2 | 7,0 | 4,7 | 100,0 | 93,13 |
| Xilol | 25,0 | 1,1 | 7,0 | 3,66 | 50,0 | 106,16 |
Az egészségi és robbanási határok összevetése
| megnevezés | alsó robbanási határ mg/m3 |
egészségre még nem ártalmas határ koncentráció mg/m3 | arány |
| aceton | 60.000 | 2400 | 25 |
| etilalkohol | 37.000 | 1900 | 19,5 |
| dietilamin | 50.000 | 30 | 1667 |
| izopropil-alkohol | 50.000 | 46 | 1087 |
| metilalkohol | 73.000 | 260 | 280 |
| toluol | 46.000 | 380 | 121 |
megjegyzés: az ATEX előírás megköveteli az egészségügyi határ betartását, ami többszöröse az alsó robbanási határnak. Ha az egészségügyi normát betartjuk, nincs robbanásveszély.
A robbanásveszélyt csökkenteni lehet
– a koncentráció megváltoztatásával
– inertizáló gáz alkalmazásával
– vákuum alkalmazásával
– TSE anyag alkalmazásával
a TSE anyag kialakítása

– ebből több méteres szálat készítenek és a tartályba rakják
– az üvegmosóra hasonlít aluminiumból készül
a robbanásbiztos kanna képe TSE anyaggal töltve

A hidrogén gyújtási energiája és a koncentrációja
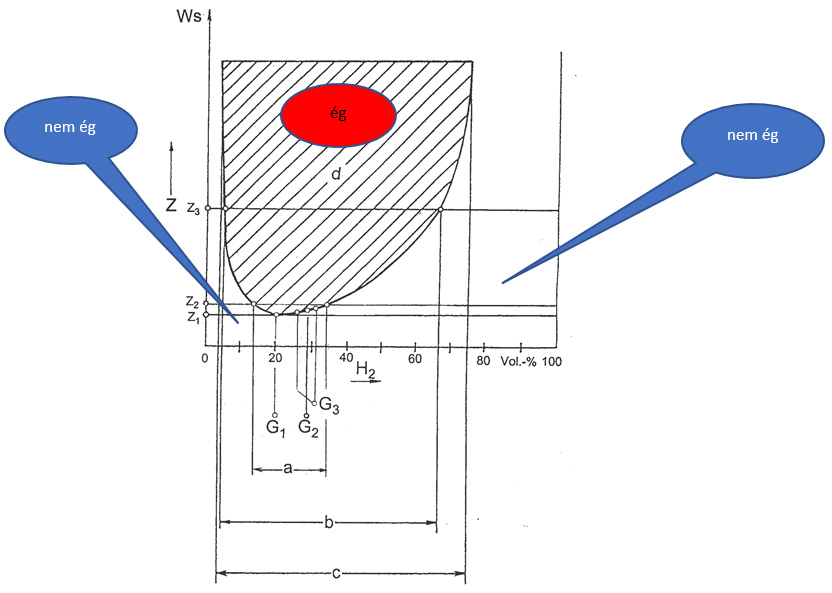
c az éghetőség határai 4-75,6 tf % 20 C0-on
b a robbanásszerű égés határai 5-66 tf %
a a detonáció jellegű égés határai 14-34 tf%
d az éghetőségi tartomány
Z1 a minimális gyújtási energiaszint
G1 a minimális gyújtási energiaértékhez tartozó koncentráció 20 μJ 21 térfogat %
G2 sztöchiometriai keverék 29,6 %
G3 a brizáns keverék 27-31 %
Az inertizálásról inert vagy nemes gázokról
argon, hélium, kripton, neon, xenon (nemes gázok)
Az inertizálás gázok gőzök esetén jól használhatók
Inertizáló hatása van a széndioxidnak és a vízgőznek is, ezek azonban sztatikusan feltöltődnek, ezért veszélyesek is lehetnek
Ha a reakciók inert gáz védelem alatt zajlanak, az oxigén a reakciókban nem vesz részt. A levegő nélküli éghető folyadékot és/vagy gázt tartalmazó reaktor belső tere a túlnyomásos inert gáz jelenlétében lezajló vegyi folyamat nem robbanásveszélyes.
A reaktor belseje nem minősül robbanásveszélyes térnek.
inertizálás a levegőben egy bar nyomásértéken
| részleges inertizálás | teljes inertizálás | ||||||
| anyag neve | hőmérséklete C0 | oxigén koncentráció az éghető anyag és levegő elegynél molban | a legalacsonyabb inertizáló érték a levegőben | a legalacsonyabb inertizáló érték a levegőben | |||
| N2 | CO2 | N2/levegő | CO2/levegő | N2 | CO2 | ||
| Cmax O2 mol %-ban | Cmax O2 mol %-ban | levegőben mol-ban | levegőben mol-ban | levegőben mol-ban | levegőben mol-ban | ||
| benzol | 100 | 8,5 | 11,8 | 1,4 | 0,7 | 42 | 22 |
| bután | 20 | 12 | 1,1 | 1,1 | – | 27 | – |
| etán | 20 | 8,8 | 11,7 | 1,3 | 0,7 | 21 | 11 |
| etilacetát | 20 | 9,8 | – | – | – | 23 | – |
| etilalkohol | 20 | 8,5 | – | 1,4 | – | 17 | – |
| etilén | 20 | 7,6 | 10,5 | 1,7 | 0,9 | 24 | 13 |
| hidrogén | 20 | 4,3 | 5,2 | 3,4 | 1,3 | 17 | 12 |
| kénhidrogén | 20 | 4,6 | – | 3,5 | – | 40 | – |
| metán | 20 | 9,9 | 13,7 | 1,0 | 0,4 | 11 | 9 |
| metilalkohol | 20 | 8,1 | – | – | – | 7 | – |
| propán | 20 | 9,8 | 12,6 | 1,1 | 0,6 | 26 | 13 |
| szénmonoxid | 20 | 4,3 | 4,6 | 3,1 | 1,7 | 6 | 3 |
| toluol | 100 | 9,6 | 12,9 | 1,1 | 0,6 | 42 | 21 |
| xilol | 100 | 9,7 | 13,1 | 1,1 | 0,6 | 42 | 21 |
